Cvforlectures
CURRICULUM VITAE TOMAS CUDRNAK PERSONAL DETAILS NAME Tomas CudrnakADDRESS 2 Mires Beck Close, Shipley, BD18 2NAE-MAIL ADDRESS [email protected] (work) +44 (0) 1612768044 FAX (work) +44 (0) 1612765642DATE OF BIRTH 07/08/1974HOME OFFICE STATUS EEA citizen - Slovak republicGMC NUMBER 6106666GMC REG. STATUS ful with specialist registration with a licence to practiceUK SPECIALIST
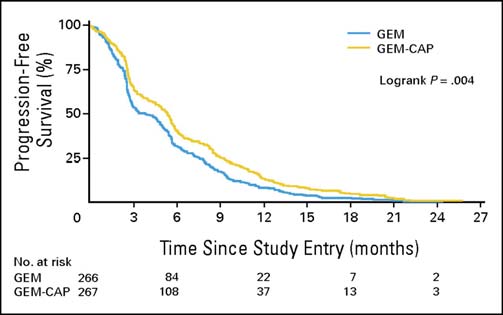
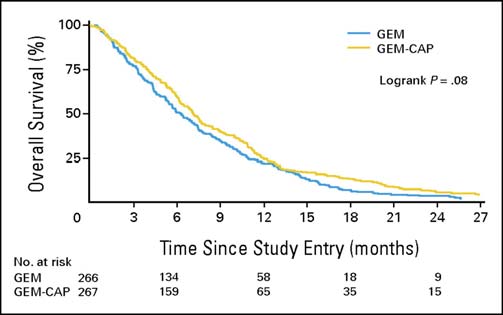 Cunningham et coll
Cunningham et coll